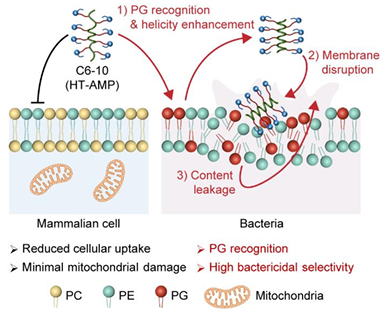
抗菌多肽(Antimicrobial Peptides, AMPs)因其优异的广谱抗菌活性和较低的耐药风险,被认为是对抗“超级细菌”的潜在新型药物。然而,其高螺旋度结构在增强杀菌效果的同时,也容易导致多肽穿透哺乳动物细胞膜并引起线粒体损伤,从而产生明显的细胞毒性。如何在保持高抗菌活性的同时显著降低细胞毒性,一直是抗菌多肽研究领域的关键科学问题。
针对上述问题,近日,武汉工程大学材料科学与工程学院蔡璐副教授与华南理工大学熊梦华教授团队合作,在抗菌多肽构象调控领域取得重要进展。研究成果以题为《Bacterial phospholipid-inducible helix-transformable antimicrobial polypeptides》的论文发表于国际顶级化学期刊《Journal of the American Chemical Society (JACS)》。武汉工程大学材料科学与工程学院夏荣庆硕士为共同第一作者,负责论文中的理论计算与分子动力学模拟工作。
研究团队提出了一种“细菌磷脂诱导的螺旋可变策略”(Helix-transformable Strategy)。通过精确调控多肽分子中阳离子侧链与主链之间的电荷距离,成功设计出一类在细菌环境下可自适应调节构象的抗菌多肽。其中,代表性分子 C6-10 在初始状态下具有中等螺旋度(约38%),难以穿透哺乳动物细胞膜,从而显著降低细胞毒性。当其识别到细菌膜中特有的阴离子磷脂——磷脂酰甘油(Phosphatidylglycerol, PG)时,侧链静电排斥作用被削弱,螺旋度显著提升至约77%,从而激发强烈的膜破坏能力,实现对细菌的高选择性杀伤。
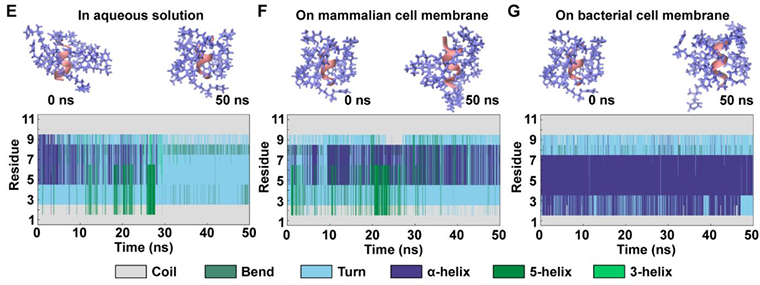
在本研究中,武汉工程大学蔡璐副教授团队通过全原子分子动力学模拟,研究揭示了C6-10分子在不同膜环境下的构象变化规律:在模拟的哺乳动物细胞膜模型中,C6-10呈现低螺旋含量,维持柔性链构象,难以嵌入膜结构;而在细菌膜模型中,C6-10能够快速转变为稳定的α-螺旋结构,牢固吸附于膜表面并引发结构扰动;均方根偏差(RMSD)与螺旋度随时间变化曲线进一步证实了C6-10在细菌环境中的构象诱导效应。这一理论结果与实验现象高度吻合,从分子水平揭示了“PG诱导螺旋转变”的机理,为该体系的构效关系提供了坚实的理论支撑。
C6-10在体外表现出高抗菌活性与极低细胞毒性;对多种耐药菌株(包括MRSA、XDR-PAE等)均展现出显著抑制效果;在小鼠膀胱感染及脓毒症模型中,C6-10实现了显著的杀菌疗效与优异的生物安全性;体内实验表明其可有效降低细菌负荷并显著提高感染模型动物的存活率。该研究通过引入“磷脂诱导构象调控机制”,实现了抗菌多肽的智能化构象响应与选择性抗菌,为抗菌多肽的结构优化与临床转化提供了全新思路。夏荣庆在理论模拟部分的贡献,为理解多肽构象变化的物理机制提供了关键依据,对未来自适应抗菌分子设计与多尺度结构优化具有重要指导意义。
论文题目: Bacterial phospholipid-inducible helix-transformable antimicrobial polypeptides
发表期刊: Journal of the American Chemical Society (JACS)
作者:Xinshuang Zhang, Dong Luo, Rongqing Xia, et al.
通讯作者:Prof. Menghua Xiong(华南理工大学),Prof. Lu Cai(武汉工程大学)
撰稿人:夏荣庆(2023级高分子材料与工程研究生)
